SYBR qPCR Mix、Probe qPCR Mix, RT-PCR、PCR、 ...
more >>发布日期:2018-12-17 返回列表
俗话说的好,“好的开始是成功的一半”,但是我们还有一句话叫做“万事开头难”,而这话在RT-PCR中则体现的淋漓尽致。第一步——如何将RNA高效地反转为cDNA,表面上看似简单,实际上则处处是陷阱,一不留神就会让斗志高昂的实验大咖们摔的鼻青脸肿,而且还不知道是咋掉坑的。显然,将RNA高效反转录成cDNA可不是那么简单哦,今天就给大家分享反转录实验中的一些Tips。
首先,反转录之前,我们需要思考的一些问题:
样本中RNA的浓度、纯度和完整性是否达到反转录的要求?
加入多少量的RNA进行反转录?
如何解决基因组DNA污染的问题?
我们所定量的目的基因的GC含量如何,高GC含量的基因如何有效的扩增?
我们所想要反转录的目的基因中,RNA是否含有二级结构?如果有二级结构,如何去除二级结构?
反转录的引物如何选择?
操作过程中需要注意哪些细节?
RNA浓度、纯度和完整性
在上一期的“qPCR实验中核酸的提取及质控”软文中,有关RNA的浓度、纯度和完整性等方面的内容我们做了详细的介绍,大家可以回顾我们上一期的内容。RNA的纯度及完整性不仅影响了反转录的效率,同时决定着定量实验的准确与否。首先,RNA样品中盐、金属离子、乙醇和苯酚残留,会抑制cDNA合成反应效率。因此,在含有杂质的RNA样品中,进行RNA的纯化是非常有必要的;其次,RNA的完整性也是非常重要的一个因素,决定了我们反转录的策略。例如,对于生物来说,我们通常用Oligo dT进行反转录实验,这对于完整性好的RNA(RIN > 7)通常是可行的,但是对于有降解的RNA来说,反转录得到的都是3’端的序列,5’端或中间的片段都没有得到有效的反转录,如果我们引物设定的位置靠5’端或中间位置,很显然得到的结果要比实际上小很多;再次,对于基因全长反转录来说,完整RNA的是必须的;最后,同一个实验中,不同组中RNA的完整性需要保证在同一水平上才能确保得到准确的定量结果。
RNA反转的起始量
反转录中RNA的起始量可以从ng到几μg,可以根据实验的实际情况进行调整,当然首先需要遵循的原则是相同起始量原则,不同样本间应用相同的RNA量进行反转录,减少系统的误差。另外,对于检测低丰度表达的基因来说,可以适当增加反转录的RNA起始量;最后,应当遵循所用试剂盒推荐的RNA用量范围,太低或者太高都会有影响反转录的效率(图1)。
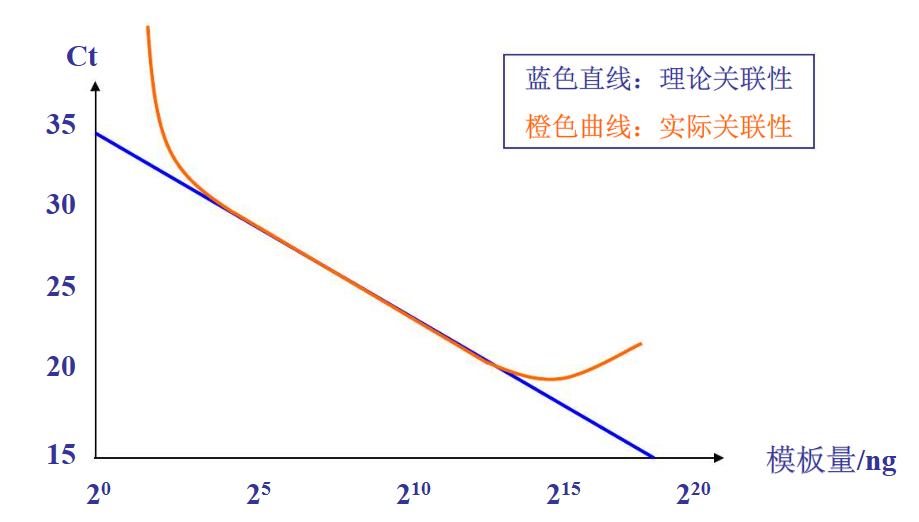
图一,起始RNA模板量对反转录效率的影响
基因组DNA污染问题
对于含有基因组DNA污染的样品,可以用DNase Ⅰ处理样本,以除去样品中残留的DNA。当今市面上成品的反转录试剂盒,大多数都会含有除基因组DNA的组份,因此,对于这个问题通常都很好解决。
高GC含量的基因反转录
对于高GC含量的目的基因反转录实验,可能是让我们头疼的问题,一般的酶对于这些高GC片段基因的反转录效率通常都比较低,现在市面上已有一些酶经过基因工程改造之后,可以耐受较高的温度,同时对高GC片段也有较好的反转录效率。因此,对于这样的实验,可以选择相对应的试剂盒;另外,针对这些高GC基因的反转录实验,可以预先65℃处理5min,随后加入反转录酶进行cDNA的合成,可以提高反转录的效率。
RNA二级结构
RNA的二级结构是阻碍cDNA有效合成的因素之一(图二),对于某一特定RT-qPCR实验来说,我们最好能够知道我们检测的某个基因,它的RNA是否含有二级结构,进而决定我们在反转录实验的策略。这里给大家推荐一款网页版的RNA二级结构预测软件—Mfold(图三),让大家更直观的了解我们所检测的基因的RNA情况。

图二,复杂模板中二级机构阻碍合成
图三,RNA二级结构预测软件
那么针对于含有二级结构的RNA模板,我们通常可以有三种策略来提高反转录效率。
一、用Oligo dT和随机引物混合进行反转,这样可以提高RNA的反转录效率,缺点是不能得到很长的cDNA(如图四),但对于qPCR来说影响不是很大。
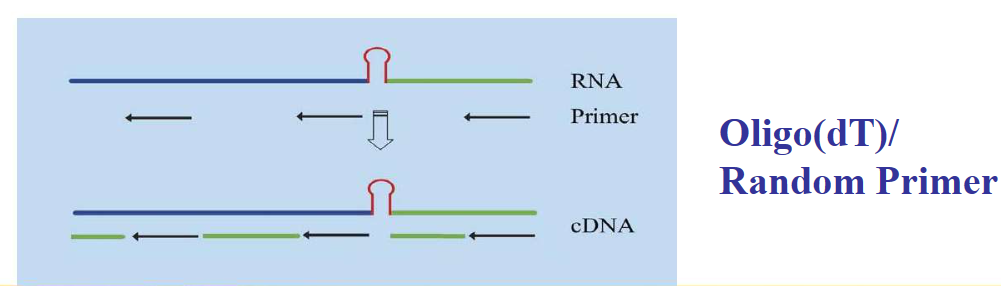
图四,Oligo dT、Random Primer混合使用提高反转录效率
二、高温条件下进行反转录(图五),利用高温把二级结构打开,优点是可以提高二级结构RNA的反转录效率,同时得到较长的cDNA。缺点是对酶的热稳定性要求很高,会损失酶的反转录效率,一般的酶在高温下很容易失活,另外这种条件下有些二级结构不能完全的打开。
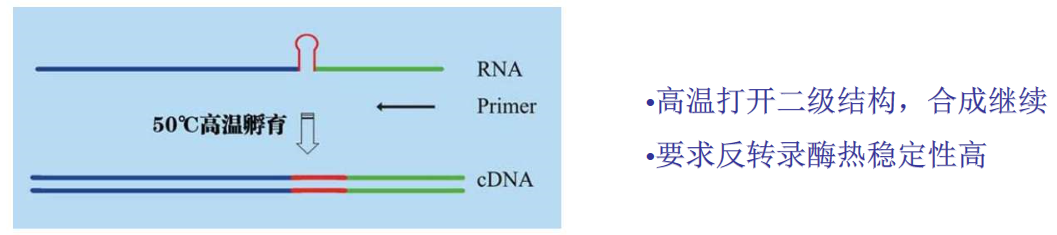
图五,高温条件下进行反转录
三、两步法进行反转录(如图六),先高温孵育,打开RNA二级结构,再加入反转录酶进行反转录反应。这样的好处是可以完全打开RNA的二级结构,提高反转录效率,另外不影响反转录酶的活性。缺点是操作上稍微繁琐一些。
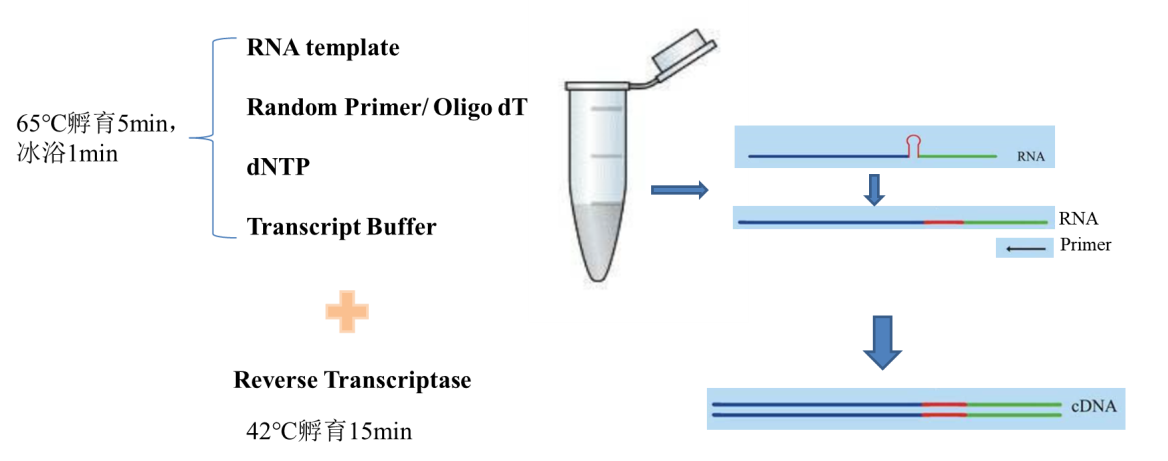
图六,两步法反转录示意图
引物的选择
随机引物,多用于原核生物的RNA反转录,另外在真核生物中也被用到,尤其在复杂模板或降解模板中RNA的反转录实验中被用到。但是它能以rRNA为模板合成cDNA,具有拷贝数被高估的风险。
Oligo dT,真核生物的反转录实验被用到(RNA含有Poly-A尾),特异性优于随机引物,但是受复杂结构影响较大,降解模板影响也大。
Oligo dT和随机引物混合使用,受复杂结构影响较小,弥补由于酶的合成长度限制,导致某些距Poly-A较远的片段用Oligo dT合成效率低的情况,通常可以1:1混合使用。
基因特异性引物,cDNA合成的特异性最好,qPCR的首选。
实验操作注意细节
RNA会被RNaseA降解,RNaseA 又无处不在,所以在提取RNA及反转录时,需避免核糖核酸酶的污染。
避免RNase污染的一般建议
因DEPC是一种强烈的RNase抑制剂,所以在RNA提取及反转录实验时,需用DEPC处理用于cDNA合成的所有管和移液器吸头或使用经过认证的无核酸酶实验室器具。
处理RNA和所有试剂时需戴上手套,因为皮肤是RNases的常见来源。 并需经常更换手套。
使用不含RNase的试剂,包括无RNase 的超纯水。
使用RNase Inhibitor(随试剂盒提供)保护RNA免受RNases的影响。
在逆转录反应时,应保持所有管密闭;在不做实验时,应保证所有反转录试剂密封保存在-20℃。
下一篇:qPCR 数据分析