SYBR qPCR Mix、Probe qPCR Mix, RT-PCR、PCR、 ...
more >>发布日期:2018-11-16 返回列表
自1985年PCR作为一种专利所属的生物技术登上分子生物学的舞台以来,迄今还没有哪一种生物技术对整个生命科学的发展产生如此深刻的影响,引用论文之多、应用范围之广。PCR以其高灵敏度、高效率扩增目的DNA的特点,广泛应用于生命科学、医疗诊断、法医检测、食品卫生和环境检测等方面。
PCR (Polymerase Chain Reaction) ,翻译成中文的全称是“聚合酶链式反应”,简单来说,在两个短核苷酸 (引物) 和耐热的DNA聚合酶的作用下,首先将待扩增DNA模板加热变性解链,之后冷却至某一温度时,引物与待扩增DNA单链接合,再将温度升高使退火引物在DNA聚合酶作用下得以延伸。这种变性-退火-延伸的过程就是一个PCR循环,不断重复,短短数十分钟就可对DNA模板进行2 n倍扩增。整个反应流程大致如下:
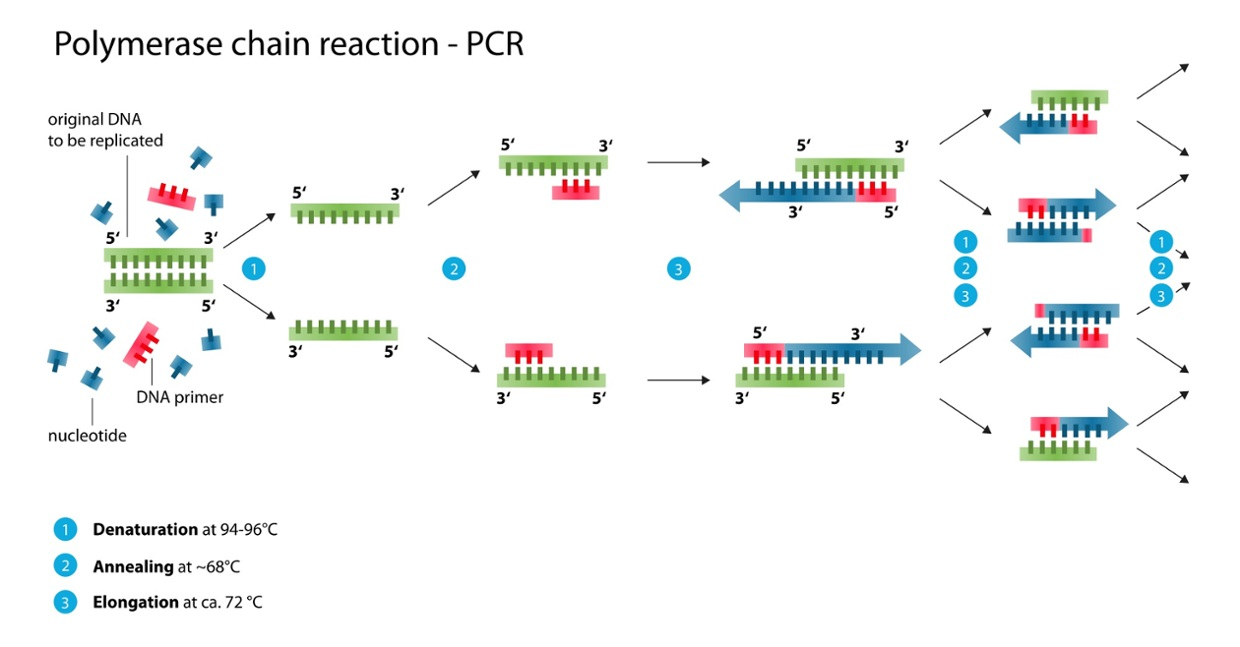
一个常规的PCR反应中所需的基本试剂组成包括:
Ø DNA模板(template),含有需要扩增的DNA片段。
Ø 一对引物(primer),决定了需要扩增的起始和终止位置。
Ø DNA聚合酶(polymerase),复制需要扩增的区域。
Ø 脱氧核苷三磷酸(dNTP),用于构造新的互补链。
Ø 含有镁离子的缓冲体系,提供适合聚合酶行使功能的化学环境。
而现在成熟PCR试剂中,往往已将除引物和模板之外的反应试剂按照优化反应的参数配置成Mix,实验时在成品Mix中直接加入目的片段和相关引物,大大简化PCR实验中试剂添加过程。
那么如此具有划时代影响力的分子生物领域技术是如何诞生的呢?在这里让我们把这段历史小小的扩展一下。让我们把时间线退回至1953年,那年发生了什么呢?新中国的第一个五年计划?奥黛丽·赫本因《罗马假日》获奥斯卡最佳女主角奖?呃呃,扯远了……(ノ`Д´)ノ 当然是沃森和克里克提出DNA是通过互补配对的碱基形成反方向平行的双螺旋脱氧核苷酸长链啦!也就是这张在生物学界流传甚广的历史照片:

上图左边那位坐着仰望的是沃森,右边站着意气风发指点模型的正是克里克^_^ 顺便插一句克里克已于2004年因病去世了,而沃森老还健在,不过克里克本来也比沃森大十二岁……
他俩依此结构进一步推测这可能暗含着遗传物质的复制机制,不过这需要实验来证明。事实上,差不多就在DNA双螺旋结构模型提出前后,Kornberg领导的小组就在研究DNA复制的机制,1956年他证实了DNA是一种能够进行自我复制的分子,并在1957年鉴定了第一个DNA聚合酶,尽管此酶功能很有限但是它打开了通往DNA复制机制研究的大门。1959年,因Kornberg发现细菌DNA复制机制和在试管中重现DNA复制过程而荣膺诺贝尔生理医学奖,1962年,Watson和Crick因DNA双螺旋结构模型也获得了诺贝尔生理医学奖。
1969年,美国印第安那大学的微生物学家Thomas Brock和他的研究生Hudson Freeze从黄石国家森林公园火山温泉中发现了一种嗜热型海栖热袍菌T.aquaticus (Taq),为后来1976年Trela和他的华裔研究生钱嘉韵Alice Chien分离纯化到耐受>75°C热稳定Taq DNA聚合酶奠定了坚实的基础(Deoxyribonucleic Acid Polymerase from the Extreme Thermophile Thermus aquaticus)。因发现遗传密码子(genetic code)及其在蛋白质合成中的功能而获得1968年诺贝尔奖的印裔学者Gobind Khorana,他指导的博士后Kleppe等人在1971年的分子生物学杂志(Journal of Molecular Biology)首先发表了后来被称为“指导PCR在技术具备可行性”的文章,他在这篇文章这样写道:
“一个双链分子想要获得两个同样的结构,并且每个都含有包括引物在内的模板链全部碱基长度,需要加入DNA聚合酶完成这样一个修补复制过程,最后,一个原来的双链分子就产生了两个同样的双链分子。整个循环过程需要不断重复,而且每次都要添加新鲜活力的聚合酶。”
在这篇文章中这位挪位籍的小伙子Kleppe明确提出了修补复制 (repair replication) 的概念,这就是后来被学界称为PCR技术的雏形,但在当时,测序技术并没有发明,热稳定性DNA聚合酶也没有发现,加之合成引物还只是停留在一种科学性质的行为艺术,所以这个想法很快被学界忘记在一边。然而好的思想就像一束火花,而散落的火星总是无意间引燃一个火种。事实上,这篇文章的工作早在1969年在新罕布什尔州 (New Hampshire)举行的高登会议上(Gordon Conference),Kleppe就向与会者描述了一个双链DNA分子产生两个同样结构的双链分子技术,而高登会议(Gordon Conference)则好比是美国学术界每年一次的“华山论剑”。值得一提的是,当时在场的听众中有一位叫Stuart Linn的教授,他在自己随后的教学中按照Kleppe描述使用这些反应组成物演示了这个试验,在场听课的学生中有一位叫Karry Mullis,是他接过PCR研究的接力棒并完成了最终冲刺。
1979年,Sanger在《美国科学院院刊》PNAS上发表了题为“链末端终止DNA测序法”的文章,在这篇文章中Sanger提到了寡核苷酸引物,DNA聚合酶和能终止反应引物延伸的、修饰过的核酸可用于DNA测序实验。仅仅一年之后,1980年Sanger再次因发明此Sanger核酸测序方法而获得诺贝尔奖,其后改进的自动化Sanger测序法成就了多国联合开展的“人类基因组学计划”。到了1980年的时候,差不多整个学术界都知道通过DNA聚合酶引物延伸可以进行DNA测序和逆转录cDNA用于克隆和表达,更重要的是,DNA聚合酶的缺口平移(nick translation)用于Southern blotting的探针标记,这种DNA杂交检测可以用于目标DNA片段的半定量检测。一切都孕育并暗示着PCR技术方法的即将降临人世,就等一个人的登场,他就是Karry Mullis博士。

限于篇幅,我们在这里仅向大家展示PCR灵感闪现出的历史性时刻吧,毕竟历史再多也会有让人感到厌倦的时候……٩(๑´0`๑)۶ 当然历史性时刻前的剧情铺垫也还是必不可少的哒,1972年,28岁的Karry Mullis获得了加州大学伯克利分校生物化学系的博士学位,但是六年来的博士研究他实际上并没有发表一篇和生化相关的论文,而是在1968年在Nature杂志上发表了这样一篇《时间反演的宇宙学意义》 ("The Cosmological Significance of Time Reversal") 的论文帮助Mullis拿到PhD博士学位……(;¬д¬)
1979年,Mullis终于进入旧金山湾区一家名叫Cetus的私人生物技术公司任职。在当时,生物技术公司还处于萌芽阶段,很少学术界人士愿意离开象牙塔的庇荫到私人企业工作,因为通常这被认为是个人学术生涯的终点(和现今生物狗难就业一模一样)。然而Cetus却是一个极为特殊的存在,这家公司集结了一批有能力、有梦想的科学家,在自由开放的风气下,共同朝既定的目标前进,这和当时一般学院里各大教授及实验室主任关起门来各行其是的做法有很大的不同。Cetus聘用Mullis,是想借重他有机化学合成的专长,负责合成不到20nt长度的寡核苷酸DNA分子,供公司内部其它部门研发使用。Mullis后来回忆道,由于公司早已实现自动化作业,他所在的部门生产了大量核苷酸片段以至于冰箱都没有空间来存放,而部门工作人员则悠闲又无所事事。
因为上班不忙,Mullis开始有时间琢磨他生产出来的核苷酸片段变性、复性的特性,通过不断实验,还摸索出一个定量计算公式,他依此推端如果能够指数增长,那么将成为快速获得大量DNA片段的一种强有力工具。碰巧,Mullis那时一直沉迷于计算机如何处理对数功能,这导致他将两个事情联系在一起。每一个分子生物学家都知道DNA复制反应(加倍),而且知道指数函数。但只有Mullis 同时想到两件事情,从而产生了指数扩增DNA的构想。Mullis意识到,小的东西如果持续加倍,则会增加得很快。例如,将一个特定的DNA片段加倍30次,则会产生230拷贝的,这么多拷贝的DNA足以让研究者进行相关的科学研究。这种想法有一天终于得以暴发。据他自己的说法,那是在1983年5月的一个周五夜晚,Mullis开着银色的本田Civic,带着公司同事也是他的第N个女友Jennifer(没错,此公的业余爱好之一就是把妹,至今已有四段婚姻)从加州湾区前往Mendocino县的乡间小屋度过一个愉快而又浪漫周末哟。在北加州蜿蜒的128高速公路上开着车,一路蜿蜒盘旋迂回的公路让他灵感突现,他的脑海中出现了这样一幅画面:蜿蜒回转的盘山公路是一段DNA双链,行驶在双车道上的汽车就是扩增时的引物,而汽车尾管排出的尾气好比是合成好的互补碱基序列。于是他停下了车,叫醒了正在熟睡的女友,激动地解释起他的想法。
Mullis原以为这样简单的想法,应该有人提出过,但搜索文献后却发现没有。在“猛然顿悟”之后的3~5个月间,Mullis并没有任何行动,这其中原因已经不得而知了,不过据知情者回忆,要么说明Cetus公司如火如荼的工作节奏根本让Mullis无暇顾及,要么说明Mullis陷入没完没了的恋爱之中,还有一种可能就是来自同事们的怀疑和不支持。同年8月,Mullis首次在公司里正式作了有关PCR原理的报告,听者反应冷淡。一来,大家已经习惯了他的胡思乱想;再者,多数人的想法是,这个原理太简单了,如果可行的话,一定早有人做过,否则,一定有什么不可行之处,但也没有人明确说得出来,为什么不可行。
于是,Mullis得着手证明这个构想的可行性。从1983年9月起,Mullis陆续进行了一些实验,换过几种DNA模板,也尝试过不同的升温、降温周期,结果都不理想,顶多只在电泳凝胶上发现一条若隐若现的条带,无法说服别人PCR起了扩增的功效。
任何研究方法从概念的提出发展到实际应用阶段,所需投入的精力与时间,大多被一般人所低估。由于Mullis以前没有接受过分子生物学的训练,公司派了技术员协助,前后一共有三位。这些人在PCR的发展上,发挥了重要的作用。1984年11月,Mullis的技术员首次取得可信的结果,证明了PCR的可行。于是在1985年初,公司决定又派上了技术精湛的日裔技术员Randall Saiki,这是一项正确的决定。在自动化的仪器出现之前,PCR是一项十分繁琐的技术,同时需要许多人在一堆试管、秒表和不同温度的水浴锅中忙个不停,甚至还要独立的作业空间防止可能的污染,这需要长时间的反复操作,手脚不利落的人是做不来的。Saiki的结果则干净漂亮,让人心服口服。
PCR的操作过程中,需要进行反复升温与降温的循环步骤,而前一次循环所使用的大肠杆菌DNA聚合酶在高温下就变性失活了,因此在每一次循环反应之后,都要加入新的聚合酶。这种做法不但繁琐,并且昂贵。按当时的价格,一次循环所需的聚合酶值1美元,30个循环下来就是30美元,循环更多次就不用说了。因此,1986年春,Mullis首次提出使用耐高温酶的想法。经过文献搜索,果然找到了两篇有关文献,较早的一篇是在美国做的,另一篇则是俄罗斯科学家的成果。
第一篇报道分离耐高温DNA聚合酶的工作,是一位来自台湾的年轻科学家钱嘉韵。1973年,钱嘉韵到俄亥俄州的辛辛那提大学生物系就读。她的导师J. Trela对一种在黄石公园的温泉里发现的嗜热菌(Thermus aquaticus,Taq)感到好奇,就让钱嘉韵及另一位美国学生以该细菌为论文研究的题目。在另一位老师的指导下,钱嘉韵成功地从该细菌分离出耐高温的Taq DNA聚合酶,并将研究成果发表在1976年的Journal of Bacteriology上。
Mullis虽然提出将Taq DNA聚合酶应用到PCR的建议,但当时并没有现成的酶可用,他得想办法自己分离。Cetus有全套分离蛋白质的设备,也有人愿意指导,但Mullis是个拖拉成性的人。等了几个月后,公司其他人只有自己动手,按着先前钱嘉韵等人发表的步骤,三个星期就纯化出Taq DNA聚合酶。1986年6月,Saiki首度将其应用于PCR,效果就好得惊人,可以说是一炮打响。Taq DNA聚合酶不但大大简化了PCR工作,同时其专一性及活性都比之前使用的大肠杆菌DNA酶更强,背景杂带也几乎都消除了。自此,PCR大获成功。1991年12月,Hoffmann Roche药厂据称以三亿美元购得了Cetus的PCR技术专利,Cetus公司也走进了历史。直到最近几年,由于之前钱嘉韵等人已经发表的工作,Taq DNA聚合酶的专利权遭到挑战,连带使PCR的专利也受到影响,不过那又是另外一个故事了。
PCR仅仅通过“变性”、“退火”、“延伸”三个步骤便实现了将微量的DNA分子在生物体外高效地进行扩增,极大的便利了分子生物学的发展,以至于Bio-Raid专门为此谱写了一曲《PCR之歌》来歌颂这一里程碑式的技术革新:

嗯,画面感还挺强,配着下面的歌词,将PCR的前世今生完美呈现^_^
There was a time when to amplify DNA,
You had to grow tons and tons of tiny cells.
Then along came a guy named Dr. Kary Mullis,
Said you can amplify in vitro just as well.
Just mix your template with a buffer and some primers,
Nucleotides and polymerases, too.
Denaturing, annealing, and extending.
Well it’s amazing what heating and cooling and heating will do.
PCR, when you need to detect mutations.
PCR, when you need to recombine.
PCR, when you need to find out who the daddy is.
PCR, when you need to solve a crime
歌声先告一段落,接着说正经╭( ̄▽ ̄)╯…… PCR技术不断持续更新的源动力在于,以模板为基础合成新链的DNA聚合酶一直在不断地发展中。在当今多样化的PCR应用中,早已无法依赖单一的野生型Taq酶走遍天下。Kapa Biosystems公司开始采用高通量的“定向进化”技术理念,为特殊PCR应用设计专门的DNA聚合酶,例如NGS。“我们在大量特殊蛋白中进行筛选,寻找能大大增强酶功能的突变体,”Kapa Biosystems的技术总监John Foskett说道,他专门为NGS文库扩增设计了高保真的KAPA HiFi DNA聚合酶。“这一产品几经优化,能够有效降低PCR扩增时的偏好性并提高产量,从而得到一致性更高的测序覆盖度,提高文库的多样性。”
随着生物实验需求的不断发展,PCR技术在其发展的历程中,已经逐渐演化出一系列侧重于不同实验目的及应用的PCR分类,其中较为常见的包括:touchdown PCR、multiplex PCR、qPCR以ddPCR。这里,我们着重介绍一下qPCR的基本原理及其广泛应用。
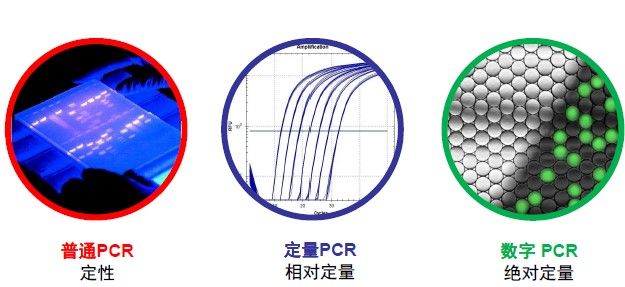
Quantitative PCR,又称为real-time PCR,是一种在DNA扩增反应中,以荧光染料或荧光标记探针侦测每次聚合酶链锁反应(PCR)循环后产物总量,并以荧光信号的形式被qPCR仪内的光学检测系统识别,最后通过绘制相关标准曲线对未知样本模板进行定量分析的方法。相比起传统的PCR,qPCR可对样本进行。
常规PCR后会将得到的PCR产物进行琼脂糖凝胶电泳,属于简单的定性分析。
而qPCR 在反应体系中引入了荧光基团(染料或者探针),可借助于对PCR产物进行标记跟踪,实时在线监控反应过程,结合相应的软件可以对产物进行分析,计算待测样品模板的初始浓度,是一种相当准确的定量方式。
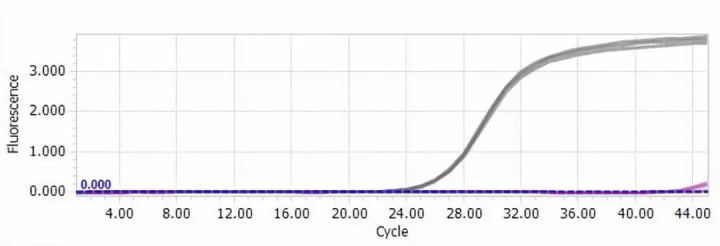
由于需要精确定量起始模板,因此qPCR结果中有两个特定的参数对评估过程至关重要,第一个参数是扩增曲线。以下图为例,横坐标代表循环数,纵坐标代表荧光强度或者相对荧光强度。反应开始时,荧光信号不稳定,呈现波动状态,随后信号会趋于稳定并且呈现指数性增长,到达一定循环数之后,荧光信号强度不再增加,持续稳定。扩增曲线展现出来为一条S型曲线,包括:基线期,指数扩增期,平台期。反应完成后,qPCR仪会以基线期荧光信号标准偏差的10倍生成一条阈值线,阈值线与扩增曲线产生交点,交点对应的横坐标代表Ct值,Ct值的含义代表每一个反应体系中荧光信号强度达到阈值时经历的扩增循环数,是后续定量计算的基础。
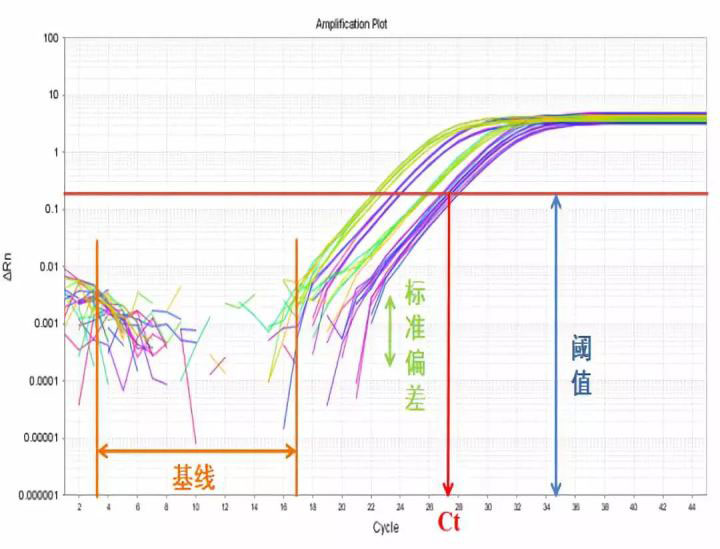
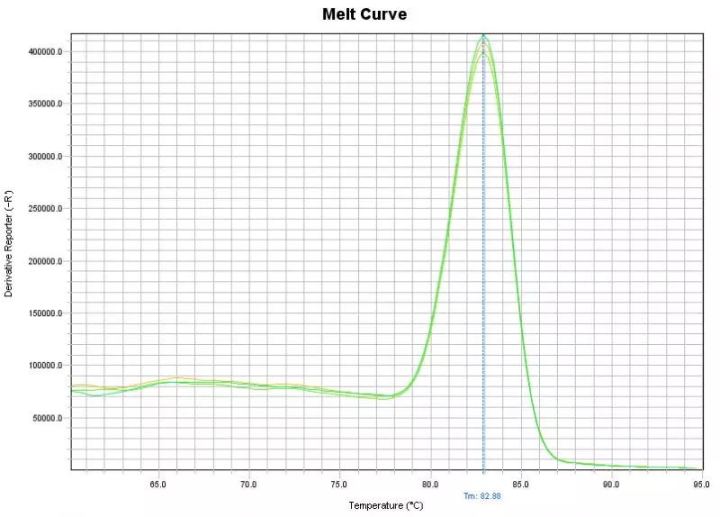
第二个重要参数就是熔解曲线。熔解曲线在反应完成之后进行检测,反映温度和荧光值之间的关系。此类检测只适用于染料法,探针法因探针水解后不能还原,故无法做此分析。从下图求导后的结果可以看出,一个峰对应一次荧光信号的跌落,每次跌落代表在这个温度范围内有一个双链产物被大量解链,因此单峰代表只有一个特异产物,多于一个峰代表存在非特异扩增产物或者引物二聚体,溶解曲线帮助我们判断的是反应的特异性。通过扩增曲线和熔解曲线分析,只有完整而且特异的反应,Ct值才真实可信,才能用于后续的定量计算。
对于qPCR实验结果的后续数据分析,通常采用如下线性函数计算:
定义初始模板量为X0,第n次循环之后产物量为Xn,那么在理想PCR条件下,Xn=X0×2n,非理想PCR条件下,我们定义引物扩增效率为Ex,Xn=X0×(1+Ex)n,两边同时取对数,将Ct值和达到Ct时产物的量X(Ct)代入整理的公式,lg X0= (- lg(1+Ex) )×C(t)+ lg Xc(t)这个最终的方程表明初始模板浓度的对数与Ct值呈线性关系,根据该线性关系,可用Ct值来进行后续表达量的计算。
在现实科研中,常常需要考虑比扩增曲线和熔解曲线更为复杂的参数指标。这里有一篇发表在临床化学上的review,The MIQE Guidelines,给出了在发表文章时所必需的最低里限度信息标准,同时该文章对qPCR的术语、概念、研究与临床应用、样本的采集、处理和制备、核酸的质量控制、反转录、qPCR过程及数据分析等方面的操作标准和规范都做了详尽的阐述。

虽然qPCR仪器的品牌和型号很多,但从工作原理上分析,都包含以下三个反应模块:激发光发射源,接收装置,PCR反应模块。
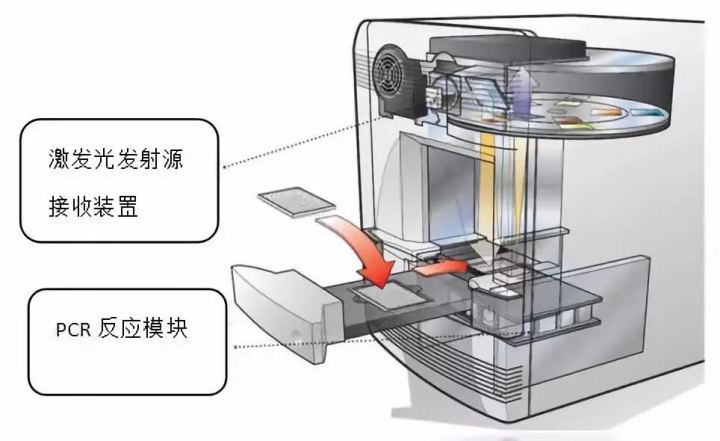
由于体系中引入了荧光基团,需要激发光发射源发出一定波长的光线,遇到荧光基团会反射另外一个波长的光线,此时被接收装置实时接收,正是由于qPCR仪比普通PCR仪增加了这两个模块,因此,qPCR的耗材比普通PCR的耗材要求更高,其顶盖的透光性必须良好。在做qPCR时不能徒手或者戴乳胶手套接触顶盖,一定要佩戴PE手套操作,防止杂质留在顶盖上影响荧光信号的发射及接收。
按照qPCR的定量方式,可分为SYBR染料法、TaqMan探针法、分子信标。
SYBR染料法利用SYBR Green I分子可结合于所有双链DNA(dsDNA)双螺旋小沟区域的具有绿色激发波长的染料这一特点来实现定量。SYBR Green I 只有和双链DNA结合后才发荧光,游离的染料分子不发光,在新合成链延伸过程中SYBR Green I 掺入双链中,变性时DNA双链解开,SYBR Green I 游离出来,无荧光。由于非特异扩增产物和引物二聚体均为dsDNA,所以SYBR染料法只能通过引物来保证特异性,其优点在于简单且成本较低,适用于样本量较少的科研客户。
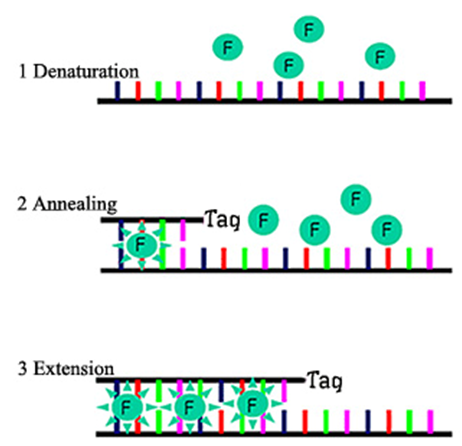
TaqMan探针法的核心是探针分子,TaqMan探针是单链DNA,5’端偶联发光基团,3’端偶联淬灭基团,游离的完整探针是检测不到荧光信号的,发光基团发出的荧光会被淬灭基团吸收淬灭,探针被水解,发光基团和淬灭基团远离就可以检测到荧光信号。
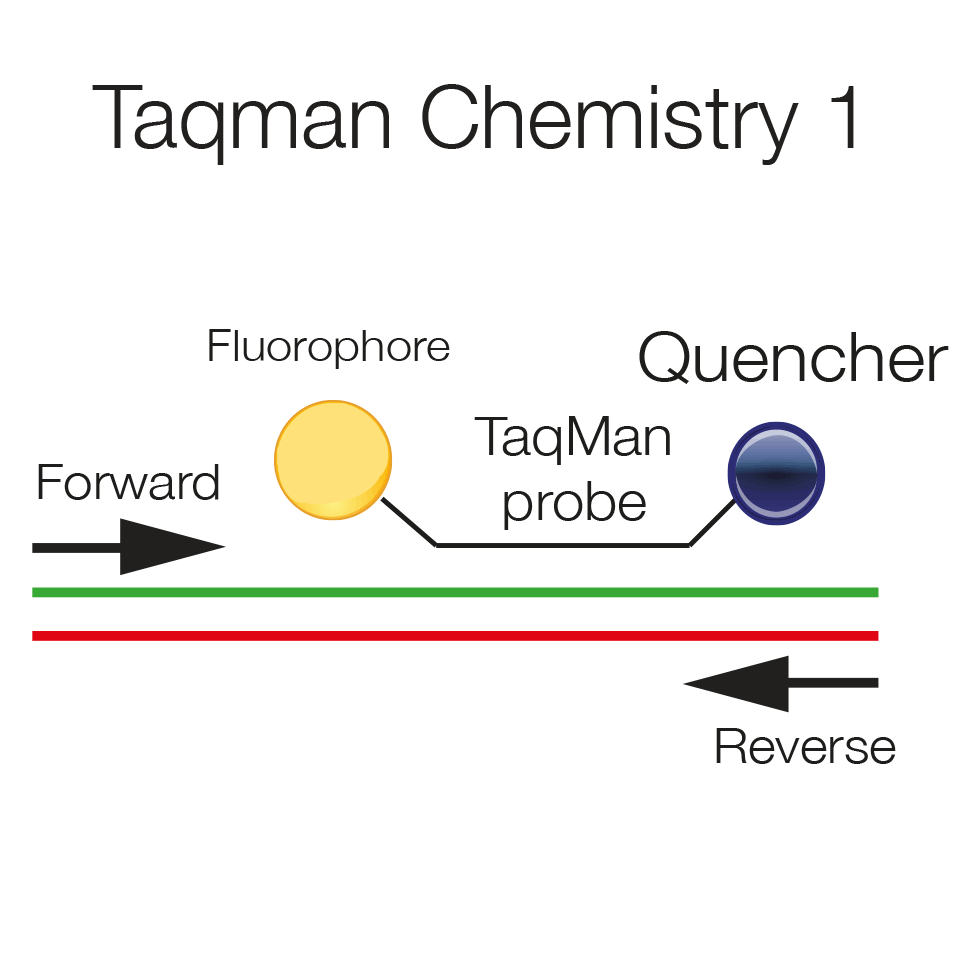
qPCR反应开始时,双链模板经加热变性解链成单链,TaqMan探针优先跟模板链退火,引物随后退火到模板上,之后进行单链延伸,延伸过程中Taq酶发挥5’-3’的外切酶活性,遇到探针会从5’端逐个碱基切除探针,发光基团会跟淬灭基团分开,因此荧光检测系统可以接收到荧光信号,每扩增一条DNA链,形成一个荧光分子,荧光信号的累积和PCR产物形成是同步的。TaqMan探针法的特异性除了由引物提供,更由探针分子保证,因其退火温度更高,所以TaqMan探针法特异性更好,在一个反应体系中加入多条探针,可以做多个基因同时检测。
分子信标类似于TaqMan探针,游离的状态下探针互补形成发卡结构,5’端藕联发光基团,3’端藕联淬灭基团。这种状态下发光基团和淬灭基团距离较近,发光基团发出的荧光会产生荧光共振能量转移现象(FRET),激发淬灭基团后信号衰减。当反应体系温度升高时,发卡结构的探针被打开,分子信标茎环区与模板链退火并结合,发光基团跟淬灭基团分离后因距离较远而不会产生FRET现象,释放的荧光信号被机内的接收装置检测到,新合成的互补链替换该分子信标,脱离模板链的信标分子又重新形成发卡结构而不再释放荧光信号。
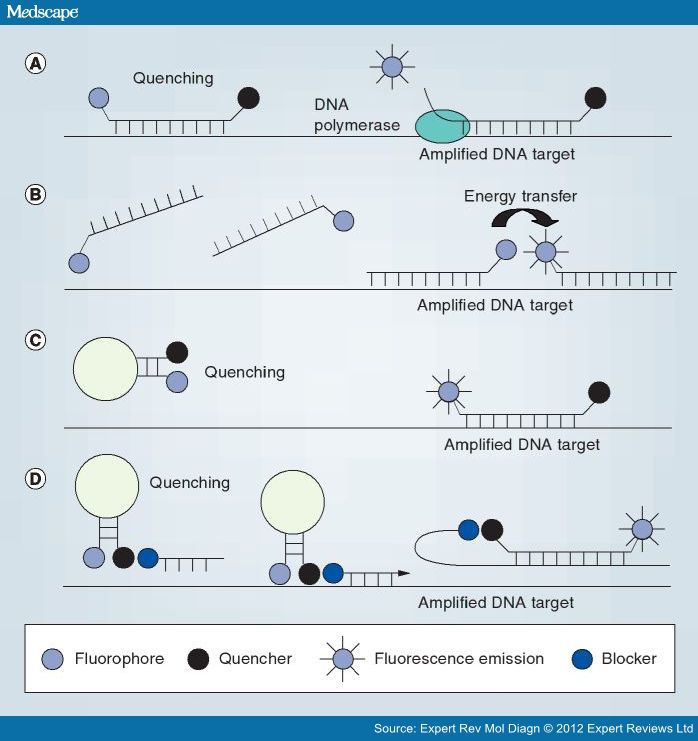
总结一下定量方式的选择,一般情况下,在科研中,绝大多数定量会选择便宜且方便的SYBR染料法,如果有更严格的定量需求,可以选择TaqMan探针法;在医疗检验中,优先选择准确并且特异的TaqMan探针法。此外,SYBR染料法适用于特异性要求不是特别高的反应、分子数(拷贝数)超过1000的反应、探针实验前进行预实验、PCR条件非常成熟、无二聚体、无非特异扩增;TaqMan探针法适用于特异性要求较高的实验、多重PCR(标记不同的荧光基团)、SNP检测、灵敏度要求较高的实验。分子信标因背景荧光极